С помощью высокоскоростной микроскопической визуализации ученые зафиксировали точный момент, когда сердечные клетки эмбрионов рыбы Данио-рерио начинают биться. Они внезапно начинают сокращаться в унисон и быстро синхронизируются. Это открытие может дать нам возможность лучше понять, как аритмия и другие пороки сердца развиваются у человека.
Развитие полноценного организма из скопления нескольких клеток — чрезвычайно сложный процесс, требующий сверхточной организации и синхронизации. У позвоночных животных сердце является одним из первых органов, начинающих функционировать в период эмбрионального развития. Однако механизм перехода от скопления статичных клеток к сократительной сети практически неизвестен. Хотя сердечная деятельность в начале эмбриогенеза документируется уже более 2 тыс. лет, наблюдения за физиологической динамикой, определяющей этот этап, относительно ограничены. Это означает, что биоэлектрические механизмы первых моментов функционирования сердца до сих пор оставались неуловимыми.
В связи с этим группа исследователей из Гарвардской медицинской школы (HMS) задалась вопросом: как эмбриональное сердце инициирует свое первое сокращение? Как координируются кардиомиоциты, чтобы регулировать ритм сокращений внутри сердечной ткани? Разработанная ими методика визуализации позволила глубоко изучить эти вопросы. "Люди придают такое большое значение сердцебиению, что оно долгое время находилось в центре внимания исследователей, но мы впервые смогли изучить его с таким разрешением", — поясняет соавтор исследования Шон Мегасон, профессор системной биологии HMS.
Понимание этих фундаментальных механизмов позволит понять механизмы, управляющие сердечной недостаточностью внутриутробно. "Сердце бьется около 3 млрд. раз за всю жизнь человека, и оно никогда не делает перерыва", — говорит Адам Коэн, также автор исследования и профессор химии, химической биологии и физики в Гарварде. "Мы хотели увидеть, как эта невероятная машина заработала в первый раз", — добавляет он.
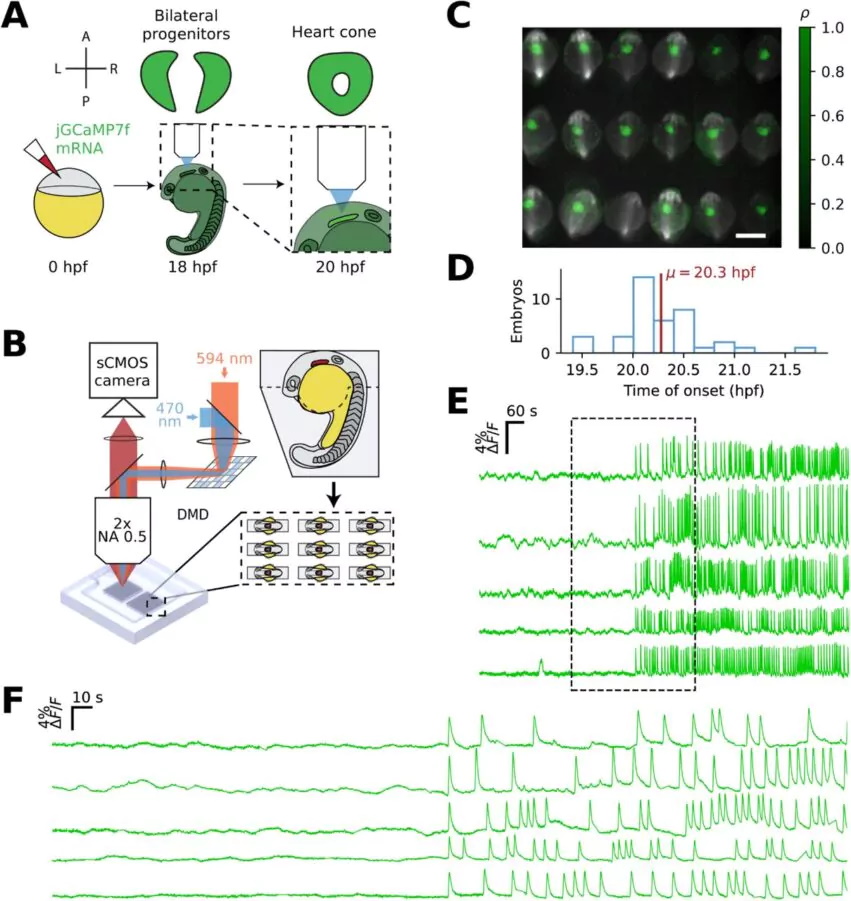
Перед проведением экспериментов по визуализации исследователи выдвинули несколько гипотез относительно первых моментов развития эмбрионального миокарда. Согласно одной из них, сначала начинают биться несколько клеток, а затем сокращения постепенно распространяются по всей ткани. Другая гипотеза предполагает, что существуют различные, удаленные друг от друга зоны, сокращающиеся независимо друг от друга, прежде чем окончательно слиться. Было также высказано предположение, что ткань в целом сначала сокращается слабо, а затем со временем набирает силу. Для проверки этого предположения была использована высокоскоростная кальциевая визуализация эмбрионов рыб данио (Danio rerio) через 18-22 часа после оплодотворения. Эта рыба является наиболее предпочтительной моделью для исследований в кардиологии, поскольку она полупрозрачна и быстро растет, не говоря уже о возможности визуализации нескольких эмбрионов одновременно.
Их развитие отслеживалось в агарозном геле, и считается, что они могут быть транспонированы в большинство позвоночных. В этот период популяции двусторонних клеток-предшественников сердца объединяются, образуя конусообразную структуру. Учитывая быструю и массовую дифференцировку этих клеток, в них был встроен датчик ионов кальция (флуоресцентный белок) для регистрации любой потенциальной активности. Благодаря интеграции крупномасштабной оптической электрофизиологической системы протокол позволил получать прямые и одновременные изображения до 18 эмбрионов.
Ускоренная мультиплексная кальциевая визуализация фиксирует первые удары сердца эмбрионов рыбок данио.
Ученые обнаружили, что ни одна из ранее высказанных гипотез не была полностью верной. К своему огромному удивлению, они обнаружили, что набор кардиомиоцитов внезапно перешел из статического состояния в сократительное. Они начали биться в унисон и спонтанно синхронизироваться. Это явление проявляется в одновременном пике кальциевых и электрических сигналов. "Это было похоже на то, как если бы кто-то щелкнул выключателем", — говорит Коэн. Переход происходил в течение узкого окна развития, длившегося около 20 часов. Более того, ритмическая динамика кальция появилась задолго до того, как были обнаружены механические сокращения. Поэтому мы можем считать, что крупномасштабный кальциевый переход представляет собой самое первое сердцебиение.
Во-вторых, исследователи пытались определить, участвует ли в первом сокращении вся ткань или только часть клеток. Предыдущие эксперименты показали, что при каждом сердечном сокращении сначала сокращается один из участков сердца, который быстро распространяет волну потенциала действия по остальным клеткам. Специалисты из Гарварда показали, что первый удар инициирует серьезные изменения, тем самым подтвердив эти результаты. Медленная, редкая, переходная активность одной клетки превращается в резкие пики в масштабах ткани. Эта активность становится более стабильной и синхронизированной уже через час после первого сокращения.
Эти результаты позволяют предположить, что кардиомиоциты могут биться по отдельности, давая начало первому объединенному сокращению. Для аналогии кардиомиоциты можно сравнить с армией, которая должна начать маршировать синхронно и без предварительной подготовки. Из, казалось бы, полного беспорядка они очень быстро организуются, и "ритмичный и пространственно структурированный ритм появляется задолго до подключения к кровеносной системе и перекачивания крови", — говорится в докладе исследователей, опубликованном в журнале Nature.
Интересно, что область первичных сокращений у каждой рыбы была разной. Это противоречит интуиции, учитывая, что клетки взрослого сердца ведут себя совершенно иначе. В зрелом сердце имеется специализированная популяция клеток-стимуляторов, которые регулируют сердечный ритм. Поскольку эмбриональные кардиомиоциты способны биться самостоятельно, "это затрудняет предсказание места первых ударов", — поясняет главный исследователь исследования Билл Цзя, также сотрудник HMS. Эти открытия могут стать серьезным шагом вперед в нашем понимании развития аритмии и других заболеваний сердца, что в перспективе может привести к разработке новых методов лечения.