Человеческое тело - это фантастическая машина, которая продолжает удивлять нас своими возможностями. Большинство наших органов постоянно обновляются, удаляя мертвые клетки и заменяя их новыми. Даже наше сердце способно к самовосстановлению после инфаркта! Американские исследователи изучили этот подвиг организма и выяснили, какие биологические механизмы участвуют в восстановлении сердечной мышцы.
Инфаркт миокарда, или "сердечный приступ", возникает при закупорке коронарной артерии, что приводит к повреждению большей или меньшей части сердечной мышцы. Несмотря на стабилизацию и "исцеление" врожденными процессами, это повреждение делает сердце постоянно хрупким. В результате сердечный приступ является наиболее распространенной причиной сердечной недостаточности, которая представляет собой неспособность сердца нормально перекачивать кровь по организму. Медикаментозное лечение (бета-блокаторы, ингибиторы ангиотензинпревращающего фермента) может снизить риск, но он все равно остается высоким.
Поэтому исследователи стремятся лучше понять механизмы, лежащие в основе естественного восстановления сердца, чтобы найти лучшие терапевтические подходы для сохранения сердечной функции. Они обнаружили, что иммунный ответ и лимфатическая система лежат в основе восстановления сердца: иммунные клетки, похожие на макрофаги, направляются к сердцу, чтобы удалить поврежденную инфарктом ткань, одновременно стимулируя образование новых лимфатических сосудов.
"Хорошие" и "плохие" макрофаги
В частности, удаление поврежденных и отмирающих клеток макрофагами - процесс, известный как эффероцитоз - также индуцирует фактор роста эндотелия сосудов С (VEGFC) - белок, роль которого заключается в том, чтобы запускать формирование новых кровеносных сосудов, необходимых для роста тканей и развития органов. Таким образом, VEGFC приводит к образованию новых лимфатических сосудов (известный как лимфангиогенез), что способствует заживлению.
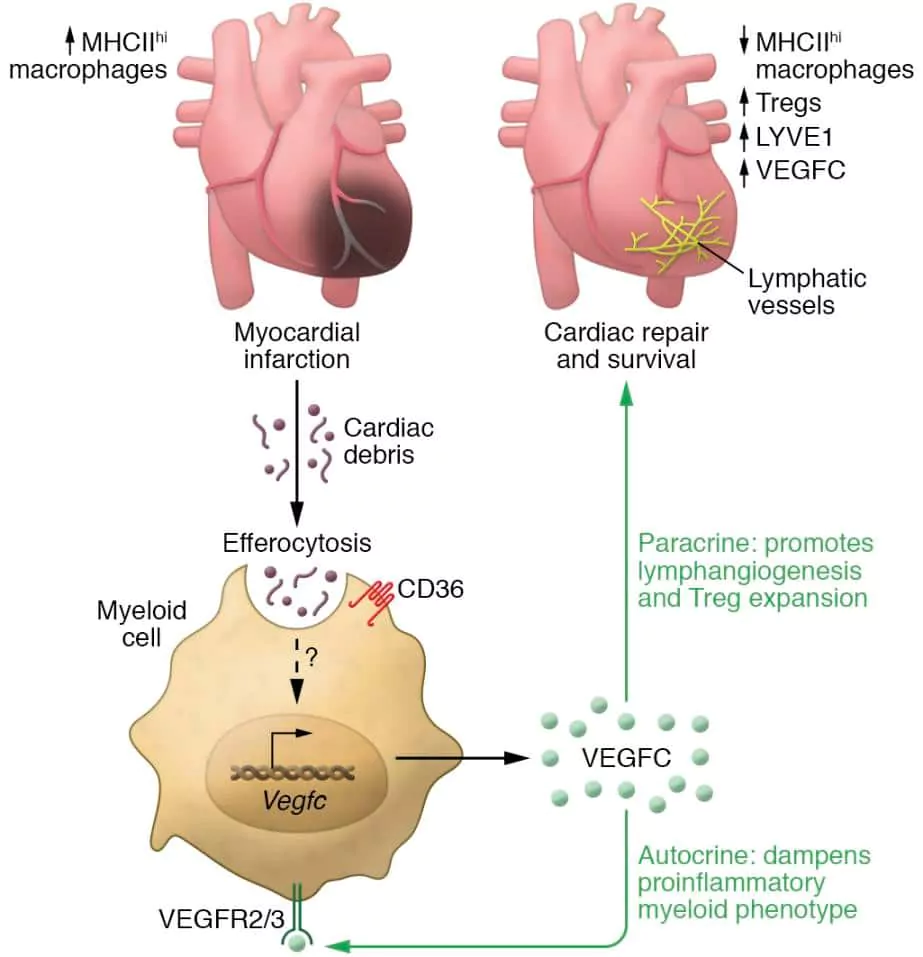
Эффероцитоз индуцирует высвобождение VEGFC из миелоидных клеток и активирует экспрессию VEGFC макрофагами с помощью механизмов, которые пока неизвестны. VEGFC подавляет продукцию провоспалительных цитокинов макрофагами и индуцирует лимфангиогенез.
Несмотря на этот невероятный механизм самовосстановления, у людей, перенесших инфаркт, сохраняется высокий риск развития сердечной недостаточности. Это связано с тем, что макрофаги, которые попадают в поражение сердца, подлежащее лечению, не все одинаковы: в то время как некоторые из них (CD11b+ макрофаги) способствуют заживлению, как описано выше, другие являются провоспалительными и не индуцируют VEGFC.
Исследователи более тщательно изучили процесс эффероцитоза в лаборатории, в культивируемых иммунных клетках и в мышиных моделях постоянной коронарной окклюзии и ишемии. Цель заключалась в том, чтобы проследить, как "хорошие" макрофаги будут восстанавливать сердце. Сначала они подтвердили, что эффероцитоз действительно индуцирует VEGFC: "Внутриклеточные доказательства эффероцитарной индукции VEGFC были обнаружены после добавления апоптотических клеток к первичным культивируемым макрофагам, которые затем вызвали транскрипцию и секрецию VEGFC", — говорится в их статье.
Команда также наблюдала на мышах, что сердечные макрофаги индуцировали повышенный уровень экспрессии VEGFC после инфаркта миокарда, а у мышей с дефицитом VEGFC наблюдалось ухудшение сократимости желудочков, нежелательное ремоделирование тканей и сниженный лимфангиогенез. Другими словами, дефектный эффероцитоз приводит к ускоренному развитию сердечной недостаточности у мышей.
Эксперименты показали, что эффероцитоз и экспрессия VEGFC зависят от рецептора CD36 на поверхности макрофагов. Однако конкретные молекулярные сигналы, приводящие к транскрипции и высвобождению VEGFC, остаются неизвестными.
"Теперь наша задача - найти способ доставки VEGFC или побудить эти макрофаги индуцировать больше VEGFC, чтобы ускорить процесс восстановления сердца", — резюмирует Эдвард Торп, доцент кафедры патологии и педиатрии Медицинской школы Файнберга Северо-Западного университета и соавтор исследования. В то же время ученым также необходимо найти способы предотвращения того, чтобы "плохие" макрофаги вызывали дальнейшее повреждение сердца и окружающих тканей.
Дальнейшие исследования, подобные этому, позволят прояснить биологические процессы, происходящие в ответ на сердечный приступ - в частности, как процесс эффероцитоза помогает запустить белок VEGFC, необходимый для восстановления сердечной мышцы.